相信诸位财务从业人员都听过一个讨论,会计到底是一门技术,还是一门艺术?这个争论,在研发支出资本化方面得到了充分体现。研发支出资本化是注册制施行两年多以来最热点的财务问题之一,引起了各方的重视,自然也伴随着诸多的争论,主要系其涉及较为主观的会计估计。由于我国的企业会计准则体系是持续趋同于国际会计准则体系的,
因此在国际会计准则(IFRS)将研发支出区分研究阶段和开发阶段,开发阶段准予资本化的前提下,我国的会计准则理所当然的采用了这一政策,这与美国企业会计准则(US GAAP)将研发支出全部费用化处理存在显著区别,因此从大的政策背景来看,研发支出资本化天然存在着更大、更宏观层面的争议。
虽然政策层面允许研发支出资本化,但在早期的IPO实践惯例中,审核部门给出的窗口指导意见更倾向于将研发投入全部费用化,这样从谨慎性角度而言,更容易被接受。但随着注册制的推进,这样的惯例被打破,2019年3月3日,上交所发布《上海证券交易所科创板股票发行上市审核问答》,明确放开了研发费用资本化的要求,并明确相关会计处理、信息披露以及核查的要求。
因为有这样的一个变化过程,于是我们很自然的产生了一个问题,是不是因为监管态度变化导致了研发支出资本化的处理出现了变化。
由于生物医药行业是研发费用投入最密集的行业之一,也是本轮资本化处理最多的行业,因此以这个行业的数据做了较为基础的统计分析。根据同花顺行业-医药生物行业(剔除医药商业)统计,截止2021年末,
包括新三板在内的医药行业内上市公司406家,我们先看下总体研发费用投入及资本化情况,由于2021年年报尚未披露,因此以截止2020年报的统计数据,情况如下:
单位:万元
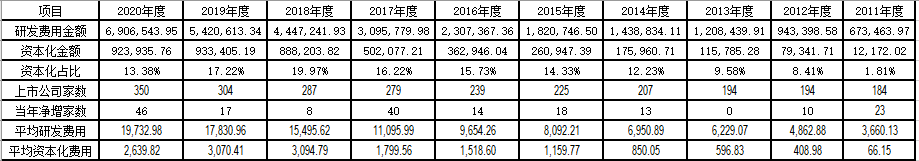
注:2020年度研发费用增加,但是资本化金额减少,分析主要系康弘药业2019年度研发资本化金额为5亿元左右,而由于该公司产品康柏西普国际Ⅲ期临床试验停止,其将截至2020年末该项目累计资本化支出共计13.97亿元(截止2019年末资本化金额约7.7亿元)全部转入当期研发费用,因此导致2020年度资本化金额相对2019年度有所下降。上述数据统计了自2011年以来各年上市公司研发费用金额、资本化金额及上市公司数量,从上述金额可以看出,研发费用金额及资本化金额都是快速增加的,资本化占比显著增加,特别是18年度以后,资本化比率及资本化金额都有一个显著跃升。与此同时,2019年度及2020年度资本化金额占比相对下降,主要系新上市公司主要为科创板企业,其中,2019年新上市17家,13家为科创板企业,2020年度新上市46家,28家为科创板上市企业,占比均超过60%,由于科创板企业相对处于研发早期,因此研发活动多处于研发阶段,就算有政策空间,也不满足资本化条件,直接计入当期损益金额较多,因此资本化率有所降低。从上表也可以看出,2016年及以前年度的研发费用投入金额维持在一个相对平缓的增长态势中,然而2017年开始呈现陡增态势,这个是为什么呢?在分析之前,我觉得可以大致归纳一下近20年中国创新药发展史:“1、2005年以前。原药监局局长郑筱萸大权独揽、药品审批注册门槛低到用钱就能敲开的地步,药品审批成为了有钱就能买的“商品”。药品临床试验数据大量造假,大量劣质、无效药通过审批进入市场。在层层加价、医院回扣中,流入百姓手中,2005年前的中国医药市场,与世隔绝。郑筱萸时代的药品审批,把中国药品做成了一个死局:资本看不上,药品也没有竞争力。2005年后,郑筱萸被免职、双规、最终判死刑。2、2005年至2015年。2万余件积压的药品申请、排队多年等审批的上百家药企、近10年用不上新药的中国人,这是整个中国医药产业几近停滞的十年。在这十年中,新药审批数量锐减,从一年通过上万件药的疯狂,跌至一个月、乃至一年几十件。这仿佛是一个“没有创新药,也看不到未来”的时代。3、2015年以后。2015年1月,毕井泉出任原国家食品药品监督管理总局局长。2015年7月22日,食药监局发布公告,对申请上市的1622个药品注册申请,要求企业自查,数据不真实的要主动撤回,这就是后来被医药界称为“7.22惨案”的临床试验数据核查公告,最终,有85.5%申请撤回,解决了大部分药品因为滥竽充数而造成审批积压件的问题。2015年8月,国办印发《国务院关于改革药品医疗器械审评审批制度的意见》,史称“44号文”,重新定义了新药和仿制药,把审评门槛提高。之前,不管在境外是否上市,只要未在中国境内上市的都叫做新药,修改后,标准和美国FDA一致:此前境内外都未上市的药,才能称为新药。仿制药也从仿制有国家标准的药,直接提高为“原研药”。大部分“混入”新药的药品,一下子丧失了专利期保护的高待遇,进入了仿制药行业。而和国外接轨的“新药”在审批上将一路绿灯。44号文也一并要求之前那些通过评审的药,为了保证质量,开启“仿制药一致性评价”。打假之后,中国药企做一致性评价的临床试验的费用水涨船高。一度,一例受试者的费用涨到了全世界最高——7万元,按照最少24名、最多100-200名的受试者,费用至少100万元以上——涨了10倍不止。2016年、2017年两年,资本大举进入临床试验机构——一个可能的“死局”,在市场的参与下盘活了。此后,加入ICH也让中国的临床数据得以嫁接全球药品监管体系,数据互通后,中国与全球的互动也多了起来。总结来讲,毕井泉主导的一系列改革政策从三个方向大力促进了整个中国的创新药行业:一是尽可能减少行政审批;二是转变创新理念,开辟了加快审批、附条件上市等快速通道;三是坚持开放与国际接轨,让中国的能快速走出去,进口的能加速引进来。”通过上述简史,我觉得应该可以明显看出研发费用的陡增是跟2015年毕井泉入局药监总局,开始大刀阔斧的药审改革,以及至最终实现了《药品管理法》的全面修订,为新药研发创新营造了良好的政策环境,引来全球资本的加持,新药研发开始进入“百花盛放、百花争艳”新时代所致,从而带来研发费用的显著增加。在较早之前,我主观感觉是因为监管口径的变化导致医药行业研发支出资本化金额的增加,然而当我结合医药行业改革史再看的时候才发现,虽然表面上看是监管口径的“放宽”导致研发费用资本化判断空间增加,然而其实本质上是医药行业顶层审批逻辑变化以及资本加持和市场环境的综合变化,推动了监管口径的变化。根据企业会计准则,财务报告的目标是向财务报告使用者提供与企业财务状况、经营成果和现金流量等有关的会计信息,反映企业管理层受托责任履行情况,有助于财务报告使用者作出经济决策。因为前述变化,带来了公司业务的变化,从而使得作为反应业务的数字化语言,会计处理结果必然会体现这一个变化,因此从客观角度而言,监管口径的变化是必然,而且这样的客观趋势,不仅使得研发支出资本化变得顺理成章,而且资本化的时点也日趋统一,早期的上市公司中,出于各种各样的动机,对于研发支出资本化的时点界定存在着显著区别,多数将其新药研发资本化的初始时点界定为取得临床试验批件时,也有部分在取得药品注册批文时,甚至如恒瑞医药般的“勇士”将其全部费用化,但是随着医药审评制度的改革,各种审核进程变得相对透明可预期,资本化时点日趋统一,比如新药研发,越来越多的上市公司或IPO企业,将其研发支出资本化的开始时点设定为进入临床三期试验时,这是一个对技术的认知趋同,也是对专业的尊重。由于研发支出资本化时点是会计估计,很多公司仅披露了其资本化政策,也就是准则条文,并未详细披露具体会计估计,因此统计较为困难,笔者也试着做了一些统计,从上述400多家公司披露的年报和会计估计变更公告中,找寻其变更记录,能找到的变更记录统计次数如下:变更时间 | 发生研发支出资本化会计估计变更企业数量 |
2008年 | 1 |
2010年 | 2 |
2012年 | 1 |
2014年 | 9 |
2015年 | 12 |
2016年 | 13 |
2017年 | 14 |
2018年 | 12 |
2019年 | 11 |
2020年 | 23 |
2021年 | 1 |
| |
从上表中,虽然看起来自2015年以后可查的会计估计变更有所增加,但这样的变更趋势并不是太明显,只是2020年有个相对高峰,笔者分析可能是行业基于前几年的观察,对相关估计取得了相对一致、稳定的判断,更多企业做出了行动。
综合以上,个人愚见,在2015年以前,由于宏观准则体系就天然存在两个选择的争议,彼时国内新药研发环境不甚理想,研发成果价值存在巨大争议,研发支出资本化的紧迫性和道义性并不那么大,因此,从监管角度而言,核准制下天然的谨慎性,使得其主观倾向选择支持尽量的费用化;然而随着环境改变,即使监管部门依然有谨慎性的考虑,但是如此巨大规模的投入,显而易见的产品价值,使得会计核算必须要与之匹配,并反应业务实际情况,因此其在制定注册制相关指引时必须要做出相关的规范指引,这既是注册制充分披露带来的契机,又是趋势,这是会计作为一门学科、或者说人文科学的内在逻辑,不以人的意志为转移。最后用一个例子来比喻,笔者以为,研发资本化就像河水,监管政策就像河堤,河水的水位提升是因为上游来水增加(研发的整体投入增加,研发成果价值增加,客观反应的市场需求增加)所致,河堤只是防止河水漫灌溢出,其并不能抬升河水,所以如果局限于对比监管政策和研发支出资本化两个因素,并据此搜集分析案例,可能会陷入幸存者偏差。
最后,推荐本人觉得对中国医药变革审评史总结甚好的一篇文章,来源于赛柏蓝旗下深度平台“深蓝观”的开篇文章《中国创新药往事》。
参考文献:
1、王印祥:播撒生命的希望火种,经济日报
2、创新不是请客吃饭,做药才是,雪球
3、从靶点到商业,从中国到世界-2020年创新药发展回顾与2021年展望,兴业证券
本文内容部分来自互联网,如有侵权请联系删除。